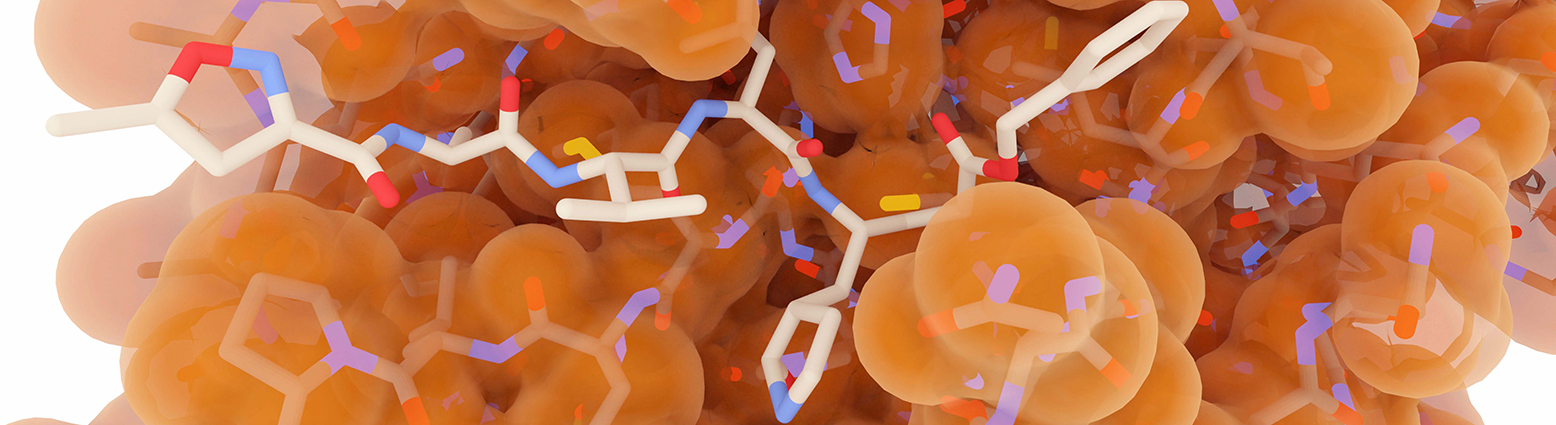
Comment la conception de médicaments assistée par ordinateur (CADD) aide-t-elle les chimistes médicinaux à optimiser les leads de médicaments ?
Sylvain Lozano, chimiste en médecine computationnelle, explique le rôle important que jouent ces outils dans notre parcours de découverte de médicaments.
Dans le monde de la découverte de médicaments, les chimistes médicinaux jouent un rôle central dans le développement de médicaments innovants. Leur expertise réside dans l’art de concevoir et de synthétiser des molécules ayant le potentiel de traiter des maladies. Cependant, l’approche traditionnelle par essais et erreurs en matière de conception de médicaments peut prendre beaucoup de temps et être très coûteuse. Heureusement, l’avènement de la conception de médicaments assistée par ordinateur (CADD) a révolutionné le domaine, en dotant les chimistes médicinaux d’outils puissants pour améliorer leur efficacité et leur productivité.
Chez Oncodesign Services, nous accordons une attention particulière à la manière dont ces outils peuvent aider nos chimistes à créer de meilleures molécules pour nos clients.
Le CADD soutient une multitude de domaines scientifiques différents, depuis l’identification de nouvelles cibles biologiques au début du processus de découverte de médicaments jusqu’à la recherche de nouvelles cibles biologiques. L’objectif principal est d’accélérer le processus de recherche. Cela peut aider les chimistes médicinaux à concevoir de nouvelles molécules en identifiant celle qui semblera la plus prometteuse.
2 approches complémentaires…
Le LBDD permet aux chimistes d’exploiter de vastes bases de données de ligands connus et de leurs activités biologiques correspondantes. À l’aide de diverses techniques informatiques, telles que la relation quantitative structure-activité (QSAR) et le criblage virtuel, les chimistes médicinaux peuvent explorer l’espace chimique plus efficacement. Ils peuvent identifier les composés principaux prometteurs avec les interactions cibles souhaitées, prioriser les efforts de synthèse et prédire l’activité et les propriétés de nouveaux composés. Le LBDD constitue un outil précieux pour guider la sélection et l’optimisation des composés, facilitant ainsi l’identification de candidats médicaments potentiels.
Au cœur du CADD : la conception de médicaments basée sur des ligands (LBDD) et la conception de médicaments basée sur la structure (SBDD)
Le LBDD se concentre sur l’utilisation des informations provenant de ligands connus pour concevoir de nouveaux composés dotés de propriétés similaires, tandis que le SBDD étudie la structure tridimensionnelle de la protéine cible pour guider la conception de molécules qui interagissent avec elle. Les deux approches offrent des outils inestimables qui peuvent aider considérablement les chimistes médicinaux à trouver de nouveaux médicaments potentiels.
D’autre part, le SBDD profite de la structure tridimensionnelle de la protéine cible pour concevoir des molécules qui interagissent avec elle de manière spécifique et sélective. Grâce à des techniques telles que l’amarrage moléculaire et les simulations de dynamique moléculaire, les chimistes médicinaux peuvent explorer les interactions entre les ligands et les cibles protéiques. Le SBDD permet la visualisation des modes de liaison, l’identification des interactions de liaison clés et l’optimisation des interactions ligand-protéine. En comprenant les relations structure-activité au niveau moléculaire, les chimistes peuvent affiner les composés principaux, optimiser leur puissance et leur sélectivité et réduire les effets hors cible.
Le LBDD et le SBDD fonctionnent en synergie avec des tests expérimentaux…
…les résultats étant réinjectés dans le modèle informatique pour éclairer les prédictions. Les données expérimentales sur l’activité biologique sont d’une réelle aide pour générer des modèles QSAR prédictifs de nouvelles molécules. Ces modèles sont utilisés pour faire des prédictions sur des bibliothèques virtuelles de molécules concernant leur activité de liaison potentielle et d’autres propriétés (par exemple la stabilité métabolique ou les propriétés pharmacocinétiques) de ces molécules.
Ces prédictions sont essentielles pour filtrer la longue liste de composés potentiels, identifier ceux qui devraient avoir la bonne plage d’activité et les comportements d’absorption, de distribution, de métabolisme et d’excrétion (ADME), qui pourraient conduire au succès en clinique. Ensuite, la molécule peut être ancrée dans la cible, pour donner un meilleur aperçu des interactions et déterminer si cela sera suffisant pour donner l’activité biologique souhaitée.
| Les propriétés prédites, combinées aux interactions simulées, aident à filtrer et à sélectionner les molécules potentielles, et à réduire de quelques milliers à quelques molécules à synthétiser. Leurs activités et propriétés sont ensuite validées expérimentalement. Les données seront réinjectées pour lancer un nouveau cycle de prédictions visant à améliorer les modèles et à concevoir des molécules encore meilleures lors du prochain cycle de conception-réalisation-test-analyse. |  |
Algorithme de prédiction de la structure des protéines
Un bon exemple d’outils CADD disponibles est AlphaFold1, de Google Deepmind, apparu pour la première fois en 2018. Une deuxième version a été publiée en 2020 et donne des prédictions encore meilleures des structures 3D des protéines, avec des calculs plus proches des structures du monde réel. Chez Oncodesign Services, nous avons déjà utilisé cet outil à bon escient. Dans une étude, nous l’avons utilisé pour découvrir le mode d’action probable d’une série de composés phares d’un client. Aucune structure cristalline n’était disponible pour la cible et le mode de liaison était inconnu. On nous a seulement donné la structure de 6 enceintes à accoster. La structure prédite par AlphaFold2 3D de la protéine a été validée par une modélisation d’homologie, puis le logiciel MOE2 a été utilisé pour rechercher des sites de liaison potentiels au sein de cette structure protéique raffinée. L’analyse statistique des interactions potentielles a conduit à une proposition de mode de liaison de 3 composés actifs parmi les 6 proposés, qui a ensuite pu être validée expérimentalement par notre client.
Screening virtuel
Un autre exemple concerne l’utilisation de modèles QSAR et de criblage virtuel pour aider à prioriser la synthèse. L’objectif était de prendre les données du client, notamment les structures chimiques ayant des activités biologiques et les structures cristallines des protéines, et de les utiliser pour proposer de nouvelles entités chimiques pour les synthétiser et les valider biologiquement. Cette fois, nous avons utilisé le logiciel Knime3 avec le package MOE. Un flux de travail global a été créé pour générer une bibliothèque de composés virtuels et automatiser la procédure d’amarrage dans la cible biologique. Les modèles QSAR ont filtré la bibliothèque contenant des milliers de molécules, prédisant leur activité vers la cible, leurs propriétés physiques et peuvent proposer un score pour faciliter l’accès à la synthèse. Enfin, un criblage virtuel automatisé a montré comment elles pouvaient s’ancrer dans la cible, réduisant ainsi la liste des molécules potentielles à un nombre beaucoup plus gérable. En prédisant lesquelles sont susceptibles de fonctionner le mieux, des ressources synthétiques précieuses pourraient être priorisées.
En conclusion, le CADD est un outil de transformation pour les chimistes médicinaux, améliorant leur processus décisionnel, leur efficacité et leur productivité. En combinant la puissance des techniques informatiques avec la validation expérimentale, le CADD permet aux chimistes de trouver de nouvelles molécules intéressantes à fabriquer plus rapidement et de sélectionner celles qui sont les plus susceptibles de fonctionner. Les décisions finales seront toujours prises par un expert humain, mais les outils peuvent les aider à trouver des idées auxquelles ils n’auraient peut-être pas pensé et à prioriser celles à prendre en premier. Le travail de l’équipe CADD est de fournir le bon outil au bon moment, pour aider nos chimistes et nos clients à obtenir des résultats positifs plus rapidement.
A propos de l’auteur
Ce blog a été rédigé par Sylvain Lozano, PhD, chimiste computationnel chez Oncodesign Services. Dans son rôle actuel, Sylvain travaille en étroite collaboration avec l’équipe de chimie médicinale pour accélérer les programmes de découverte de médicaments.
Si vous souhaitez en savoir plus sur la chimie médicinale et notamment la conception assistée par ordinateur de médicaments, contactez notre équipe.
Vous souhaitez échanger avec nos experts ?