


Etudes précliniques pour les maladies pulmonaires inflammatoires
Les maladies inflammatoires pulmonaires aiguës et chroniques comptent parmi les pathologies les plus courantes dans le monde. Les modèles d’inflammations pulmonaires de rongeurs permettent de déchiffrer les mécanismes sous-jacents qui déclenchent et entretiennent la maladie observée chez les patients.
Oncodesign Services propose plusieurs modèles précliniques utilisables pour différentes pathologies pulmonaires, et offre le développement de nouveaux modèles d’inflammation pulmonaire récemment décrits dans la littérature.
Critères d’évaluation standards pour les maladies inflammatoires pulmonaires
- Poids corporel
- Poids pulmonaire
- Rapport poids pulmonaire/poids corporel
- Score clinique
- Œdème
- Score de fibrose
- Production de mucus
- Charge virale
- Fonction pulmonaire ex vivo, y compris compliance et élasticité (FlexiVent, SCIREQ)
- Sécrétion de cytokines et numération cellulaire sur le liquide de lavage broncho-alvéolaire (LBA)
- TDM
- Expression génique dans les poumons, par PCR quantitative/génétique
- Surveillance de biomarqueurs/médicaments
Les voies d’administration médicamenteuse fréquentes (orale, intraveineuse, intrapéritonéale) et voies d’administration atypiques utilisées pour les thérapies pulmonaires sont les suivantes :
- Voie intra-trachéale
- Voie intra-nasale
- Mini-pompes osmotiques
Découvrez les solutions d’Oncodesign Services pour les maladies pulmonaires inflammatoires
-
Etudes In vitro
- Cellules :
- HPASMC (cellules musculaires lisses d’artère pulmonaire humaine)
- HPAEC (cellules endothéliales d’artère pulmonaire humaine)
- Criblage :
- Formation de collagène (modèle dit « scar-in-a-jar »)
- Test d’impédance (signalisation)
- Évaluation de la transition épithélio-mésenchymateuse
- Substitut de l’hypertension artérielle pulmonaire (HTAP)
- Cellules :
-
Modèles In vivo
Oncodesign-Services a développé des modèles robustes pour déployer des services CRO qui fournissent des données de grande qualité. Si vous ne trouvez pas le modèle que vous recherchez dans cette liste, veuillez nous contacter.
- Modèle murin de bronchiolite induite par le virus respiratoire syncytial humain (VRS)
- Modèle murin d’asthme allergique induit par des acariens domestiques
- Modèle murin d’asthme résistant aux corticoïdes induit par ovalbumine (OVA) + Influenzae
- Modèle murin d’exacerbation de l’asthme induit par l’association VRS + acariens domestiques
- Modèle murin de fibrose pulmonaire induite par la bléomycine, administrée par voie intra-trachéale ou par pompe osmotique
Etude de cas pour les maladies pulmonaires inflammatoires
-
#1 Modèle d’asthme allergique induit par les acariens domestiques
Les acariens domestiques représentent l’une des sources majeures d’allergènes intérieurs et un facteur sous-jacent significatif dans la rhinite allergique et l’asthme allergique. L’exposition intra-nasale à des acariens domestiques peut être utilisée chez des souris BALB/c pour reproduire de nombreuses caractéristiques clés de l’asthme clinique :
- Exposition à des acariens domestiques par voie intra-nasale 5 jours par semaine pendant 3 semaines
- Niveaux élevés d’IgE
- Inflammation des voies respiratoires
- Hyperplasie des cellules caliciformes avec surproduction de mucus
- Libération de médiateurs inflammatoires et de cytokines principalement associés à une inflammation de type Th2
- Sensible à la fluticasone (corticoïde inhalé)
Les résultats mettent en évidence une signature allergique dans le liquide de lavage broncho-alvéolaire (LBA) ainsi que dans le plasma, qui se manifeste par la sécrétion de cytokines et la teneur en cellules dans le LBA, ainsi que par les taux d’IgE plasmatiques.
Results show allergic signature in bronchoalveolar lavage fluid (BALF) and in plasma with BALF cell content & cytokine secretion, and with plasma IgE levels.
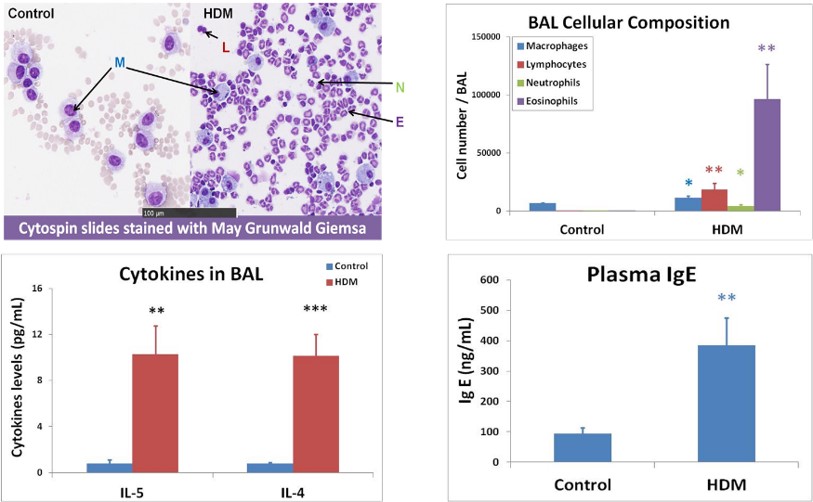
Allergic signature inbronchoalveolar lavage (BAL) and in plasma :
- BAL cell content & cytokine secretion
- Plasma IgE levels
-
#2 Modèle de bronchiolite – Infection par le virus respiratoire syncytial (VRS) chez des souris BALB/c
Le virus respiratoire syncytial (VRS)est un virus responsable de manifestations respiratoires sévères telles que rhinite, bronchiolite et pneumonie. Environ 65 % des enfants sont infectés par le VRS au cours de leur première année de vie.
La maladie est modélisée en administrant une dose élevée de VRS par instillation intra-nasale à des souris BALB/c, ce qui déclenche une infection virale et des symptômes de bronchiolite. La production excessive de mucus par les voies respiratoires est une caractéristique de cette maladie pulmonaire inflammatoire et constitue un critère clé d’évaluation histologique. La ribavirine est généralement utilisée comme produit de référence.
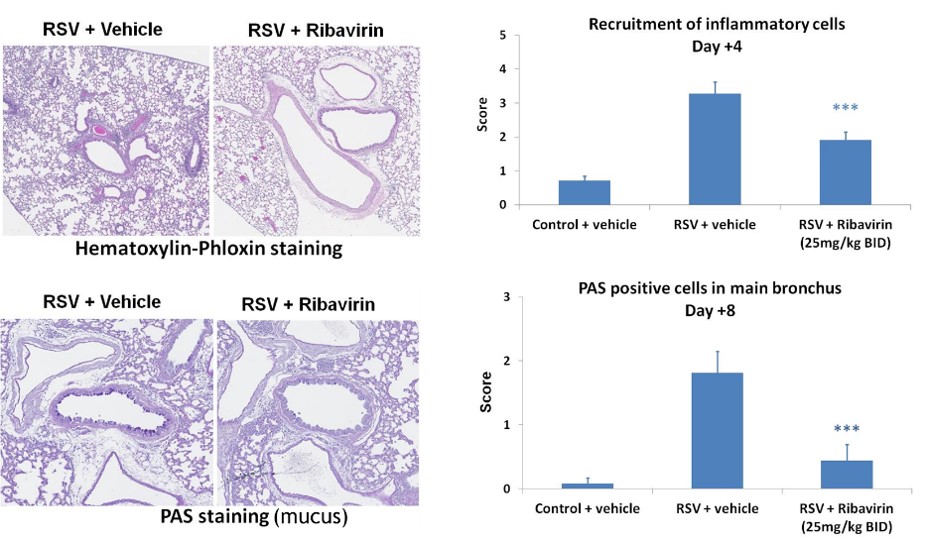
-
#3 Modèle de fibrose pulmonaire induite par la bléomycine par instillation intra-trachéale
À ce jour, le modèle murin de lésion pulmonaire induite par la bléomycine reste le modèle animal le plus largement utilisé pour étudier la fibrose pulmonaire résultant de l’inflammation.
Comme pour la pathologie humaine, l’exposition à la bléomycine chez la souris est associée à des lésions épithéliales, une infiltration par des cellulaires inflammatoires et la prolifération de fibroblastes et de myofibroblastes, ainsi qu’à des dépôts excessifs dans la matrice extra-cellulaire.
Préparation du modèle : administration intra-trachéale (IT) de bléomycine au jour 0 chez des souris mâles C57BL/6 (n = 8 animaux/groupe au minimum après la randomisation).
Conception de l’étude d’Oncodesign Services pour obtenir des données robustes
- J0 : administration unique de bléomycine ou de sérum physiologique sous anesthésie par kétamine/xylazine
- J7 : sélection de bons répondeurs à la bléomycine (sur la base du % de perte de poids)
- Taux de sélection de ± 65 % – environ 12 animaux par groupe pour obtenir 8 animaux sélectionnés par groupe
- J7 à J21 : traitement
- Vers J21 : euthanasie des animaux
Examen histologique pulmonaire à J21 pour l’évaluation du médicament antifibrotique
- Inhibiteur d’ALK5 (récepteur du TGF-β de type I) [SB-525334] : efficace à 30 ou 60 mg/kg/jour (avec une relation dose-effet reposant sur Cmax)
- Nintédanib (inhibiteur des tyrosines kinases) : pas d’effet à 60 ou 100 mg/kg/jour
- Pirfénidone (cible moléculaire inconnue) : pas d’effet à 300 ou 500 mg/kg/jour
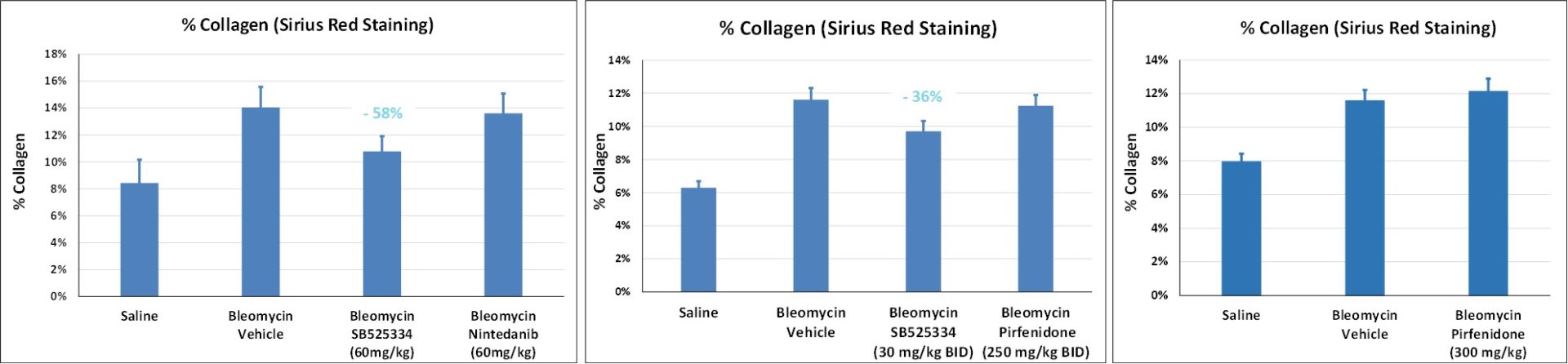
-
References
(1) Bronchiolitis model in mice, induced by Human Respiratory Syncytial Virus (RSV)
Borchers AT, Chang C, Gershwin ME, Gershwin LJ. Respiratory syncytial virus–a comprehensive review. Clin Rev Allergy Immunol. 2013 Dec;45(3):331-79. doi: 10.1007/s12016-013-8368-9. PMID: 23575961; PMCID: PMC7090643.
https://pubmed.ncbi.nlm.nih.gov/23575961/
https://link.springer.com/article/10.1007/s12016-013-8368-9
Taylor G. Animal models of respiratory syncytial virus infection. Vaccine. 2017 Jan 11;35(3):469-480. doi: 10.1016/j.vaccine.2016.11.054. Epub 2016 Nov 29. PMID: 27908639; PMCID: PMC5244256.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5244256/
Ceneviva ZJ, Norlander AE, Stokes Peebles R Jr. Mouse Models of Respiratory Syncytial Virus Infection. Methods Mol Biol. 2022;2506:19-41. doi: 10.1007/978-1-0716-2364-0_2. PMID: 35771461.
https://pubmed.ncbi.nlm.nih.gov/35771461/
Tregoning JS, Yamaguchi Y, Harker J, Wang B, Openshaw PJ. The role of T cells in the enhancement of respiratory syncytial virus infection severity during adult reinfection of neonatally sensitized mice. J Virol. 2008 Apr;82(8):4115-24. doi: 10.1128/JVI.02313-07. Epub 2008 Feb 13. PMID: 18272579; PMCID: PMC2293007.
https://pubmed.ncbi.nlm.nih.gov/18272579/
Sebina I, Phipps S. The Contribution of Neutrophils to the Pathogenesis of RSV Bronchiolitis. Viruses. 2020 Jul 27;12(8):808. doi: 10.3390/v12080808. PMID: 32726921; PMCID: PMC7472258.
https://pubmed.ncbi.nlm.nih.gov/32726921/
(2) Allergic asthma model in mice, induced by House Dust Mice (HDM)
Gao X, Leung TF, Wong GW, Ko WH, Cai M, He EJ, Chu IM, Tsang MS, Chan BC, Ling J, Fan X, Lu L, Lam CW, Wong CK. Meteorin-β/Meteorin like/IL-41 attenuates airway inflammation in house dust mite-induced allergic asthma. Cell Mol Immunol. 2022 Feb;19(2):245-259. doi: 10.1038/s41423-021-00803-8. Epub 2021 Nov 30. PMID: 34848868; PMCID: PMC8803866.
https://pubmed.ncbi.nlm.nih.gov/34848868/
Debeuf N, Haspeslagh E, van Helden M, Hammad H, Lambrecht BN. Mouse Models of Asthma. Curr Protoc Mouse Biol. 2016 Jun 1;6(2):169-184. doi: 10.1002/cpmo.4. PMID: 27248433.
https://pubmed.ncbi.nlm.nih.gov/27248433/
Oikonomou N, Schuijs MJ, Chatzigiagkos A, Androulidaki A, Aidinis V, Hammad H, Lambrecht BN, Pasparakis M. Airway epithelial cell necroptosis contributes to asthma exacerbation in a mouse model of house dust mite-induced allergic inflammation. Mucosal Immunol. 2021 Sep;14(5):1160-1171. doi: 10.1038/s41385-021-00415-5. Epub 2021 May 27. PMID: 34045680; PMCID: PMC8379077.
https://pubmed.ncbi.nlm.nih.gov/34045680/
Ma M, Li G, Qi M, Jiang W, Zhou R. Inhibition of the Inflammasome Activity of NLRP3 Attenuates HDM-Induced Allergic Asthma. Front Immunol. 2021 Aug 3;12:718779. doi: 10.3389/fimmu.2021.718779. PMID: 34413860; PMCID: PMC8369415.
https://pubmed.ncbi.nlm.nih.gov/34413860/
Maes B, Smole U, Vanderkerken M, Deswarte K, Van Moorleghem J, Vergote K, Vanheerswynghels M, De Wolf C, De Prijck S, Debeuf N, Pavie B, Toussaint W, Janssens S, Savvides S, Lambrecht BN, Hammad H. The STE20 kinase TAOK3 controls the development of house dust mite-induced asthma in mice. J Allergy Clin Immunol. 2022 Apr;149(4):1413-1427.e2. doi: 10.1016/j.jaci.2021.08.020. Epub 2021 Sep 8. PMID: 34506849.
https://pubmed.ncbi.nlm.nih.gov/34506849/
(3) Corticoid-resistant asthma in mice, induced by Ovalbumin (OVA) + Influenzae
Essilfie AT, Simpson JL, Dunkley ML, Morgan LC, Oliver BG, Gibson PG, Foster PS, Hansbro PM. Combined Haemophilus influenzae respiratory infection and allergic airways disease drives chronic infection and features of neutrophilic asthma. Thorax. 2012 Jul;67(7):588-99. doi: 10.1136/thoraxjnl-2011-200160. Epub 2012 Mar 3. PMID: 22387445.
https://pubmed.ncbi.nlm.nih.gov/22387445/
Kim RY, Pinkerton JW, Essilfie AT, Robertson AAB, Baines KJ, Brown AC, Mayall JR, Ali MK, Starkey MR, Hansbro NG, Hirota JA, Wood LG, Simpson JL, Knight DA, Wark PA, Gibson PG, O’Neill LAJ, Cooper MA, Horvat JC, Hansbro PM. Role for NLRP3 Inflammasome-mediated, IL-1β-Dependent Responses in Severe, Steroid-Resistant Asthma. Am J Respir Crit Care Med. 2017 Aug 1;196(3):283-297. doi: 10.1164/rccm.201609-1830OC. PMID: 28252317.
https://pubmed.ncbi.nlm.nih.gov/28252317/
(4) Asthma exacerbation model in mice, induced by RSV + HDM combination
Zhang D, Yang J, Zhao Y, Shan J, Wang L, Yang G, He S, Li E. RSV Infection in Neonatal Mice Induces Pulmonary Eosinophilia Responsible for Asthmatic Reaction. Front Immunol. 2022 Feb 2;13:817113. doi: 10.3389/fimmu.2022.817113. PMID: 35185908; PMCID: PMC8847141.
https://pubmed.ncbi.nlm.nih.gov/35185908/
https://www.frontiersin.org/articles/10.3389/fimmu.2022.817113/full
Makino A, Shibata T, Nagayasu M, Hosoya I, Nishimura T, Nakano C, Nagata K, Ito T, Takahashi Y, Nakamura S. RSV infection-elicited high MMP-12-producing macrophages exacerbate allergic airway inflammation with neutrophil infiltration. iScience. 2021 Oct 2;24(10):103201. doi: 10.1016/j.isci.2021.103201. PMID: 34703996; PMCID: PMC8524145.
https://pubmed.ncbi.nlm.nih.gov/34703996/
Matsuse H, Hirose H, Tsuchida T, Fukahori S, Fukushima C, Mizuta Y, Kohno S. Effects of respiratory syncytial virus infection on dendritic cells and cysteinyl leukotrienes in lung tissues of a murine model of asthma. Allergol Int. 2007 Jun;56(2):165-9. doi: 10.2332/allergolint.O-06-476. Epub 2007 May 1. PMID: 17460444.
https://pubmed.ncbi.nlm.nih.gov/17460444/
(5) Lung fibrosis model in mice, induced by Bleomycin delivered IT or by osmotic pumps
Herrmann FE, Hesslinger C, Wollin L, Nickolaus P. BI 1015550 is a PDE4B Inhibitor and a Clinical Drug Candidate for the Oral Treatment of Idiopathic Pulmonary Fibrosis. Front Pharmacol. 2022 Apr 20;13:838449. doi: 10.3389/fphar.2022.838449. PMID: 35517783; PMCID: PMC9065678.
https://www.frontiersin.org/articles/10.3389/fphar.2022.838449/full
Lee R, Reese C, Bonner M, Tourkina E, Hajdu Z, Riemer EC, Silver RM, Visconti RP, Hoffman S. Bleomycin delivery by osmotic minipump: similarity to human scleroderma interstitial lung disease. Am J Physiol Lung Cell Mol Physiol. 2014 Apr 15;306(8):L736-48. doi: 10.1152/ajplung.00210.2013. Epub 2014 Feb 28. PMID: 24583879; PMCID: PMC3989726.
https://pubmed.ncbi.nlm.nih.gov/24583879/
Liang M, Lv J, Zou L, Yang W, Xiong Y, Chen X, Guan M, He R, Zou H. A modified murine model of systemic sclerosis: bleomycin given by pump infusion induced skin and pulmonary inflammation and fibrosis. Lab Invest. 2015 Mar;95(3):342-50. doi: 10.1038/labinvest.2014.145. Epub 2014 Dec 15. PMID: 25502178.
https://www.nature.com/articles/labinvest2014145
Hübner RH, Gitter W, El Mokhtari NE, Mathiak M, Both M, Bolte H, Freitag-Wolf S, Bewig B. Standardized quantification of pulmonary fibrosis in histological samples. Biotechniques. 2008 Apr;44(4):507-11, 514-7. doi: 10.2144/000112729. PMID: 18476815.
https://pubmed.ncbi.nlm.nih.gov/18476815/
Egger C, Gérard C, Vidotto N, Accart N, Cannet C, Dunbar A, Tigani B, Piaia A, Jarai G, Jarman E, Schmid HA, Beckmann N. Lung volume quantified by MRI reflects extracellular-matrix deposition and altered pulmonary function in bleomycin models of fibrosis: effects of SOM230. Am J Physiol Lung Cell Mol Physiol. 2014 Jun 15;306(12):L1064-77. doi: 10.1152/ajplung.00027.2014. Epub 2014 Apr 11. PMID: 24727584.
https://pubmed.ncbi.nlm.nih.gov/24727584/
De Langhe E, Cailotto F, De Vooght V, Aznar-Lopez C, Vanoirbeek JA, Luyten FP, Lories RJ. Enhanced endogenous bone morphogenetic protein signaling protects against bleomycin induced pulmonary fibrosis. Respir Res. 2015 Mar 15;16(1):38. doi: 10.1186/s12931-015-0202-x. PMID: 25849157; PMCID: PMC4364322.
https://pubmed.ncbi.nlm.nih.gov/25849157/
Dackor RT, Cheng J, Voltz JW, Card JW, Ferguson CD, Garrett RC, Bradbury JA, DeGraff LM, Lih FB, Tomer KB, Flake GP, Travlos GS, Ramsey RW Jr, Edin ML, Morgan DL, Zeldin DC. Prostaglandin E₂ protects murine lungs from bleomycin-induced pulmonary fibrosis and lung dysfunction. Am J Physiol Lung Cell Mol Physiol. 2011 Nov;301(5):L645-55. doi: 10.1152/ajplung.00176.2011. Epub 2011 Aug 19. PMID: 21856819; PMCID: PMC3213994.
https://pubmed.ncbi.nlm.nih.gov/21856819/
Phillips JE, Peng R, Burns L, Harris P, Garrido R, Tyagi G, Fine JS, Stevenson CS. Bleomycin induced lung fibrosis increases work of breathing in the mouse. Pulm Pharmacol Ther. 2012 Aug;25(4):281-5. doi: 10.1016/j.pupt.2011.10.001. Epub 2011 Oct 20. Erratum in: Pulm Pharmacol Ther. 2022 Jun;73-74:102122. PMID: 22024054.
https://pubmed.ncbi.nlm.nih.gov/22024054/
