Services de recherche intégrées pour les programmes d’immuno-oncologie
Oncodesign Services propose une suite complète de capacités intégrées permettant de répondre aux besoins des programmes d’immuno-oncologie (IO) en matière d’études in vitro, in vivo et bioanalytiques. Nous prenons en charge les besoins particuliers des recherches sur les anticorps bispécifiques, les cellules CAR-T et les autres thérapies d’immuno-oncologie depuis 2022.
Besoins spécifiques des programmes d’immuno-Oncologie
Les thérapies qui cherchent à moduler les cellules immunitaires au sein du microenvironnement tumoral font appel à des animaux hôtes dotés de compartiments immunitaires fonctionnels. Les approches in vivo les plus appréciées pour la modélisation des interactions entre tumeur et système immunitaire sont les modèles de tumeurs murines syngéniques et les souris humanisées porteuses de xénogreffes CDX ou PDX. En tenant compte des avantages et des contraintes de chacune de ces approches, Oncodesign Services élabore une stratégie de développement sur mesure, idéalement adaptée aux besoins du programme d’immuno-oncologie .
Les études syngéniques sont faciles à mettre en œuvre mais peuvent s’avérer inadaptées si le traitement ne présente pas de réactivité croisée chez la souris. Les modèles syngéniques sont courantes et Oncodesign Services peut s’appuyer sur une longue expérience dans ce domaine, ce qui nous a permis de caractériser parfaitement ces modèles pour étudier la réponse à des médicaments. Découvrez notre liste de modèles syngéniques et leurs réponses à des traitements de référence sur la page dédiée à notre Banque tumorale.
Les modèles de tumeurs murines syngéniques sont des outils efficaces de développement de médicaments. Ces modèles comprennent des composants murins (antigènes tumoraux, cellules effectrices murines, etc.) et permettent ainsi au système immunitaire de la souris et aux tumeurs murines d’interagir au sein d’un microenvironnement tumoral (MET) pleinement fonctionnel. Les limitations d’emploi comprennent les situations où 1) les stratégies thérapeutiques sont uniquement humaines sans équivalent XXX et 2) les médicaments sont entièrement humanisés (anticorps, simples et bispécifiques, thérapies cellulaires, thérapies géniques).
Dans les expériences menées chez la souris, l’humanisation du compartiment immunitaire est incomplète, d’où la nécessité de procéder à une reconstitution adaptée du système immunitaire humain pour étudier le mode d’action de médicaments dans un micro-environnement tumoral (MET) spécifique. Les modèles humanisés présentent plus de variabilité et n’offrent qu’une fenêtre étroite de réponse thérapeutique avant la survenue d’une réaction du greffon contre l’hôte (GvHD) ou d’une anémie, généralement 4 à 6 semaines après la greffe pour les modèles humanisés utilisant des cellules mononuclées du sang périphérique (PBMC) ou 8 semaines après le début de l’humanisation pour les modèles humanisés utilisant des cellules souches hématopoïétiques (CSH).
Vous trouverez ici plus d’informations sur notre plateforme d’humanisation.
Méthodes d’analyse et critères d’évaluation courants en immuno-oncologie
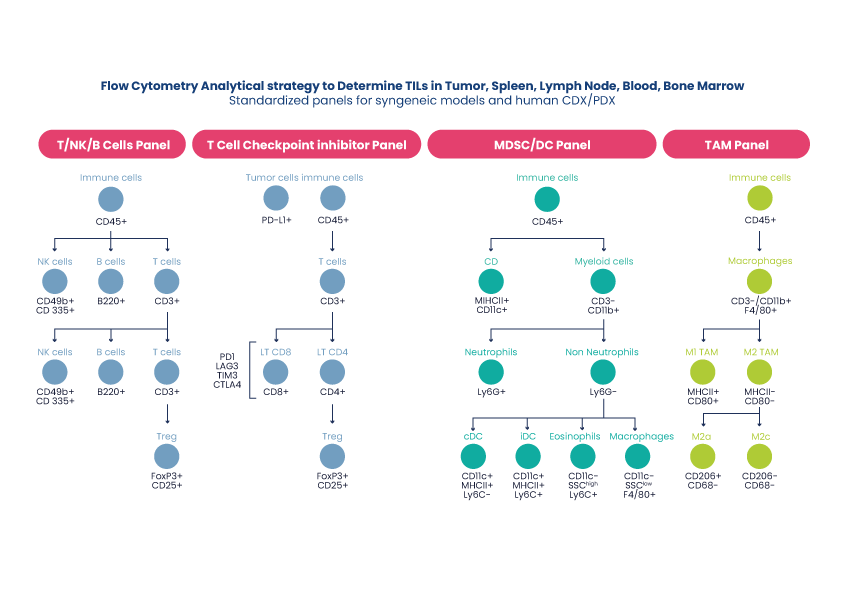
Comme pour les études d’oncologie, les critères d’évaluation principaux sont la taille et la survie de la tumeur et la survie. Toutefois, les études d’immuno-oncologie comprennent souvent des analyses ex vivo des lymphocytes infiltrant la tumeur (TIL) et un profilage des cytokines à partir du sérum. Les prélèvements frais de tumeurs dissociées, de ganglions lymphatiques et de sang terminal sont analysés par cytométrie de flux/FACS, tandis que les échantillons FFIP sont étudiés par immunohistochimie pour comprendre le stroma et le microenvironnement tumoral (MET).
Découvrez ici la plateforme d’étude des biomarqueurs d’Oncodesign Services.
Analyses d’immuno-oncologie in vitro
Une reproduction du MET in vitro représente un objectif ambitieux qui doit encore être validé par la recherche translationnelle. Toutefois, quelques approches in vitro plus modestes de reconstitution du stroma peuvent s’avérer utiles pour atténuer les risques liés au développement de thérapies d’immuno-oncologie avant le passage aux études in vivo :
- Réponse phénotypique de cellules tumorales seules ou de PBMCs seules à un traitement titré, in vitro, avec évaluation par imagerie cellulaire, cytométrie de flux/analyses FACS ou sur plaques d’essai. Par ex. l’apoptose médiée par des anticorps. Les analyses d’expression génétique sont également appréciées.
- Co-cultures mécanistiques de cellules tumorales et de populations immunitaires choisies pour les études portant sur le mécanisme d’action. Par ex. co-cultures de cellules dendritiques et tumorales pour des études portant sur la phagocytose. Méthode également validée pour les co-cultures de lymphocytes NK et de cellules tumorales.
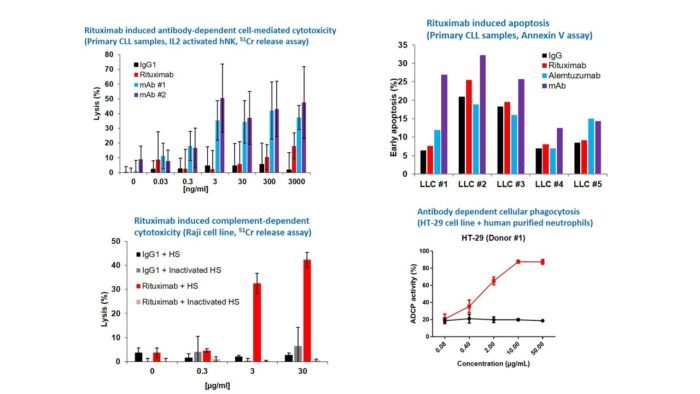
Exemple n°1 :
Divers types de modèles cellulaires ont été traités avec l’anticorps Rituximab, qui a manifesté toute une série de mécanismes aboutissant à la destruction des cellules cancéreuses. Le Rituximab induisait une apoptose dans des modèles de leucémie lymphoïde chronique (LLC). Le Rituximab induisait une cytotoxicité dépendante du complément (CDC) dans une lignée de cellules tumorales Raji. Un autre dispositif d’essai avec cet anticorps déclenchait une phagocytose à médiation cellulaire dépendante des anticorps (ADCP) chez des neutrophiles humains purifiés en présence de cellules HT-29. Des tests de cytotoxicité à médiation cellulaire dépendante des anticorps (ADCC) sont également disponibles. Ces analyses peuvent être adaptées pour des thérapies cellulaires, notamment en utilisant des lymphocytes NK pour l’ADCC, des macrophages ou des neutrophiles pour l’ADCP.
Exemple n°2 :
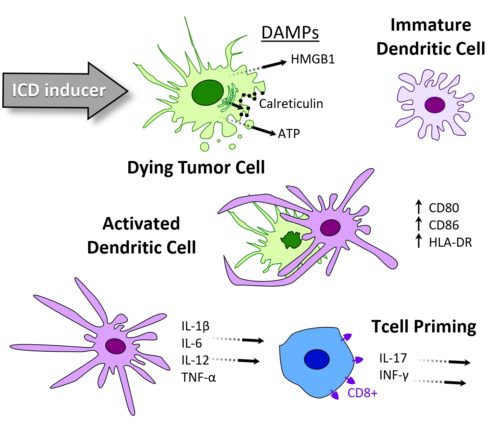
La mort cellulaire immunogène (MCI) est un type de mort des cellules tumorales qui suscite une réponse immunitaire persistante. Il s’agit donc d’un mécanisme endogène assimilable à une vaccination contre le cancer. La plateforme MCI d’Oncodesign Services prévoit trois analyses en cascade développées pour caractériser des substances en termes de potentiel d’induction de MCI. L’étape n°1 implique la caractérisation de la mort des cellules tumorales, l’étape n°2 confirme l’activation des cellules dendritiques et l’étape n°3 quantifie l’amorçage des lymphocytes T. Toutes les xénogreffes CDX ne répondent pas à des inducteurs de MCI. Oncodesign Services, qui a commencé à développer cette plateforme en 2017, a pu identifier à ce jour plusieurs modèles CDX souris/homme utilisables pour l’étude de la MCI. N’hésitez pas à nous solliciter pour tous renseignements.
Vous trouverez des informations complémentaires sur notre plateforme d’analyses cellulaires ici.
Exemple #3 :
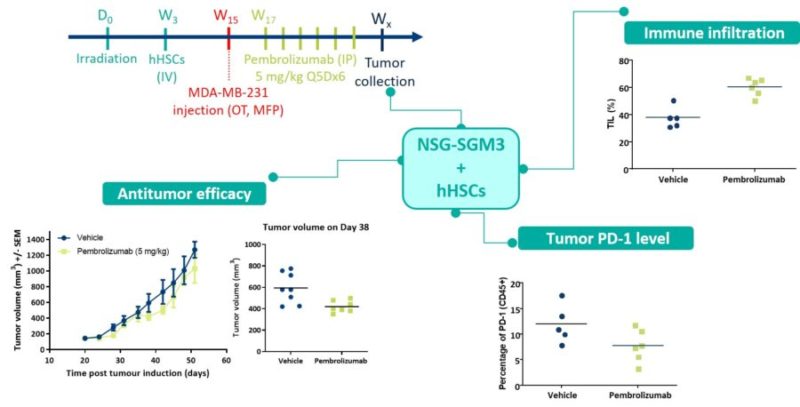
Un inhibiteur de checkpoint immunitaire, le Pembrolizumab, a fait l’objet d’analyses d’efficacité au moyen du modèle sous-cutané de cancer du sein MDA-MB-231 chez des souris NSG-SGM3 humanisées avec des cellules souches hématopoïétiques humaines (CSHh). En se basant sur la taille de la tumeur comme seul critère d’évaluation, le médicament semblait apporter une amélioration limitée en matière de croissance tumorale. Mais des données ultérieures sur l’infiltration immunitaire ont montré qu’environ 60 % du volume tumoral traité consistait en cellules immunitaires. Ces résultats indiquent que le médicament est plus efficace que ne l’avaient laissé penser les premières données, la réduction de la masse tumorale ayant été masquée par le volume de l’infiltrat immunitaire. La quantification de la protéine PD-1 dans le tissu stromal a confirmé que l’inhibiteur de checkpoint agissait en atténuant l’expression du checkpoint.
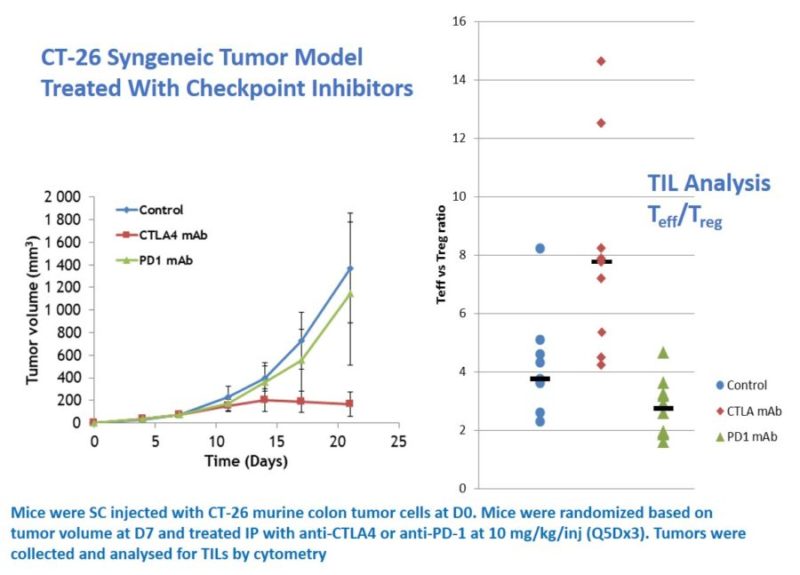
Example #4: Un modèle syngénique
Des souris ont reçu, à J0, une injection de cellules de tumeur du côlon murin CT-26. Les souris ont été randomisées sur la base du volume tumoral à J7 et traitées par voie intra-péritonéale (IP) avec des anticorps anti-CTLA4 ou anti-DP-1 pour étudier leur activité antitumorale. Les volumes tumoraux ont été mesurés quotidiennement, puis les tumeurs ont été dissociées en vue de réaliser une analyse des lymphocytes infiltrant la tumeur (TIL) par cytométrie en flux/FACS. Ces analyses ont montré que le traitement par anticorps anti-CTLA4 avait modifié de manière significative la balance lymphocytes T effecteurs/régulateurs (Teff/Treg) dans le MET.