


Etudes précliniques pour les maladies inflammatoires systémiques
Les maladies inflammatoires systémiques sont déclenchées par une activation dérégulée des cellules immunitaires. On observe fréquemment de telles inflammations systémiques dans divers cas de greffe d’organes ou de choc septique. Les études sur des modèles de rongeurs permettent de déchiffrer les mécanismes qui déclenchent ou entretiennent la maladie chez des patients.
Oncodesign Services offre l’accès à plusieurs modèles précliniques abordant plusieurs mécanismes de l’inflammation systémique, et fournit un soutien au développement de modèles de recherche répondant à vos besoins spécifiques.
Critères d’évaluation pour l’inflammation systémique
- Score clinique
- Poids corporel
- Température corporelle (pour les modèles de choc)
- Survie
- Examen histopathologique
- Surveillance de biomarqueurs/médicaments
- Expression génique dans les tissus pertinents, par PCR quantitative/génétique
- Phénotypage immunitaire
Découvrez les solutions d’Oncodesign Services pour les maladies inflammatoires systémiques
-
Analyses in vitro
- Stimulation des monocytes primaires humains par le LPS ou le TNF-α
- Stimulation par le ligand TLR sur des CMSP humaines et du sang total humain
- Stimulation par le ligand TLR sur la lignée de macrophages murins RAW 264.7
-
Liste des modèles d’inflammation systémique
- Maladie du greffon contre l’hôte, allogénique, avec des souris Balb/c (H2d) irradiées ou des souris C57b6D2F1 (H2d).
- Maladie du greffon contre l’hôte, xénogénique, chez des souris NOG.
- Syndrome de réponse inflammatoire systémique, induit par le TNF-α, provoquant une hypothermie.
- Réponse systémique à IFN-γ, induite par IL-12/IL-18.

Etude de cas pour les maladies inflammatoires systémiques
-
#1 GVHD xénogénique
La maladie du greffon contre l’hôte (GVHD) est une complication inflammatoire majeure suite à une transplantation de cellules hématopoïétiques, environ 50 % des patients développant une telle réaction. Les modèles de GVHD xénogénique utilisent des cellules de donneur humain transplantées dans des souris NOG immuno-déficientes, avec une surveillance sur plus de 30 jours. La cyclosporine est généralement utilisée comme molécule de référence.
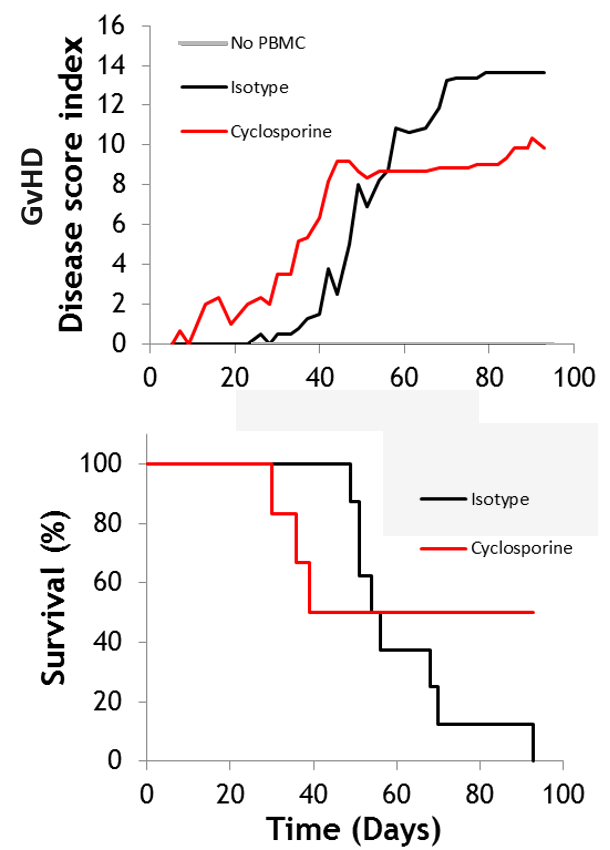
-
#2 Modèle murin de GVHD xénogénique
Des souris NOG reçoivent une transplantation de CMSP humaines par voie IP. L’analyse de la population de lymphocytes T humains effectuée par cytométrie en flux est utilisée pour la surveillance longitudinale de la fréquence des leucocytes humains (hCD45+) dans le sang. Des infiltrats immunitaires humains sont également observés dans des tissus tels que le tractus gastro-intestinal.
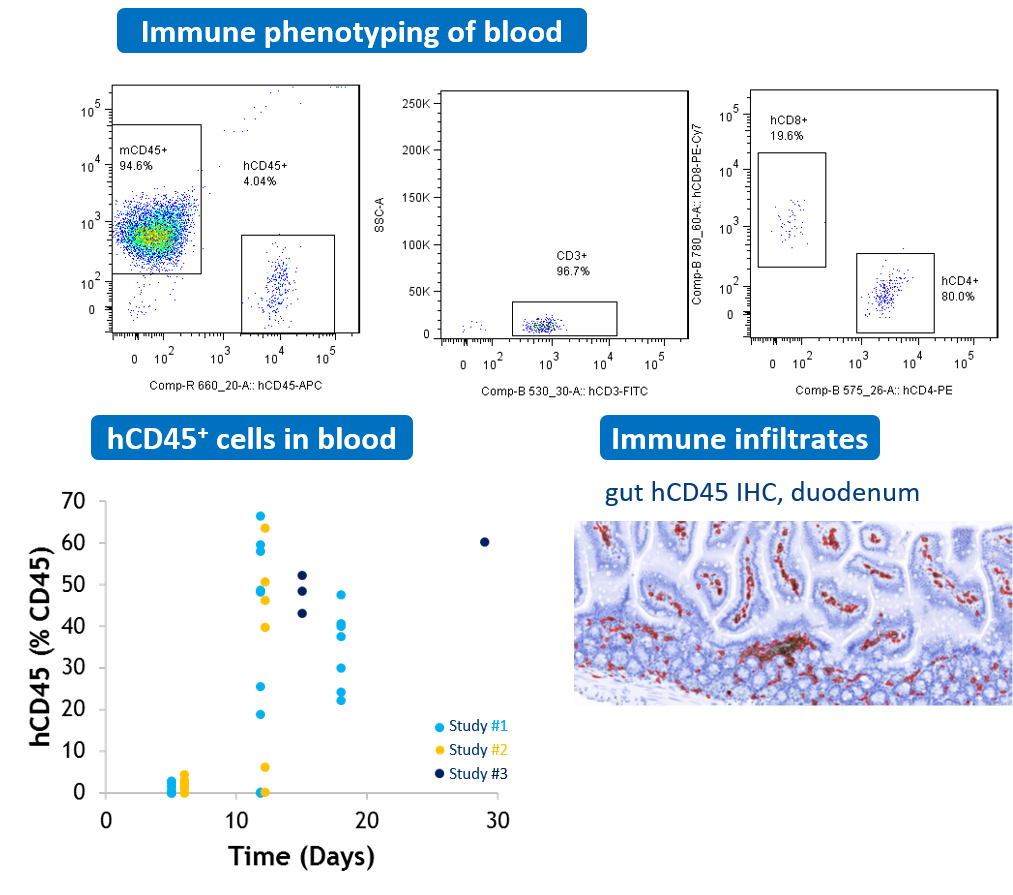
-
Références
(1) Graft-versus-host disease:
Ito R, Katano I, Kawai K, Hirata H, Ogura T, Kamisako T, Eto T, Ito M. Highly sensitive model for xenogenic GVHD using severe immunodeficient NOG mice. Transplantation. 2009 Jun 15;87(11):1654-8. doi: 10.1097/TP.0b013e3181a5cb07. PMID: 19502956.
https://pubmed.ncbi.nlm.nih.gov/19502956/
Schroeder MA, DiPersio JF. Mouse models of graft-versus-host disease: advances and limitations. Dis Model Mech. 2011 May;4(3):318-33. doi: 10.1242/dmm.006668. PMID: 21558065; PMCID: PMC3097454.
https://pubmed.ncbi.nlm.nih.gov/21558065/
Ye C, Yang H, Cheng M, Shultz LD, Greiner DL, Brehm MA, Keck JG. A rapid, sensitive, and reproducible in vivo PBMC humanized murine model for determining therapeutic-related cytokine release syndrome. FASEB J. 2020 Sep;34(9):12963-12975. doi: 10.1096/fj.202001203R. Epub 2020 Aug 9. PMID: 32772418; PMCID: PMC7436391.
https://pubmed.ncbi.nlm.nih.gov/32772418/
Elhage A, Sligar C, Cuthbertson P, Watson D, Sluyter R. Insights into mechanisms of graft-versus-host disease through humanised mouse models. Biosci Rep. 2022 Sep 30;42(9):BSR20211986. doi: 10.1042/BSR20211986. PMID: 35993192; PMCID: PMC9446388.
https://pubmed.ncbi.nlm.nih.gov/35993192/
(2) Systemic inflammatory response syndrome, induced by TNFa, causing hypothermia.
Duprez L, Takahashi N, Van Hauwermeiren F, Vandendriessche B, Goossens V, Vanden Berghe T, Declercq W, Libert C, Cauwels A, Vandenabeele P. RIP kinase-dependent necrosis drives lethal systemic inflammatory response syndrome. Immunity. 2011 Dec 23;35(6):908-18. doi: 10.1016/j.immuni.2011.09.020. PMID: 22195746.
https://pubmed.ncbi.nlm.nih.gov/22195746/
Harris PA, Berger SB, Jeong JU, Nagilla R, Bandyopadhyay D, Campobasso N, Capriotti CA, Cox JA, Dare L, Dong X, Eidam PM, Finger JN, Hoffman SJ, Kang J, Kasparcova V, King BW, Lehr R, Lan Y, Leister LK, Lich JD, MacDonald TT, Miller NA, Ouellette MT, Pao CS, Rahman A, Reilly MA, Rendina AR, Rivera EJ, Schaeffer MC, Sehon CA, Singhaus RR, Sun HH, Swift BA, Totoritis RD, Vossenkämper A, Ward P, Wisnoski DD, Zhang D, Marquis RW, Gough PJ, Bertin J. Discovery of a First-in-Class Receptor Interacting Protein 1 (RIP1) Kinase Specific Clinical Candidate (GSK2982772) for the Treatment of Inflammatory Diseases. J Med Chem. 2017 Feb 23;60(4):1247-1261. doi: 10.1021/acs.jmedchem.6b01751. Epub 2017 Feb 10. PMID: 28151659.
https://pubmed.ncbi.nlm.nih.gov/28151659/
Zelic M, Roderick JE, O’Donnell JA, Lehman J, Lim SE, Janardhan HP, Trivedi CM, Pasparakis M, Kelliher MA. RIP kinase 1-dependent endothelial necroptosis underlies systemic inflammatory response syndrome. J Clin Invest. 2018 May 1;128(5):2064-2075. doi: 10.1172/JCI96147. Epub 2018 Apr 16. PMID: 29664014; PMCID: PMC5919800.
https://pubmed.ncbi.nlm.nih.gov/29664014/
(3) Systemic IFNg response, IL-12/IL-18-induced.
Burke JR, Cheng L, Gillooly KM, Strnad J, Zupa-Fernandez A, Catlett IM, Zhang Y, Heimrich EM, McIntyre KW, Cunningham MD, Carman JA, Zhou X, Banas D, Chaudhry C, Li S, D’Arienzo C, Chimalakonda A, Yang X, Xie JH, Pang J, Zhao Q, Rose SM, Huang J, Moslin RM, Wrobleski ST, Weinstein DS, Salter-Cid LM. Autoimmune pathways in mice and humans are blocked by pharmacological stabilization of the TYK2 pseudokinase domain. Sci Transl Med. 2019 Jul 24;11(502):eaaw1736. doi: 10.1126/scitranslmed.aaw1736. PMID: 31341059.
https://pubmed.ncbi.nlm.nih.gov/31341059/
Nakamura S, Otani T, Ijiri Y, Motoda R, Kurimoto M, Orita K. IFN-gamma-dependent and -independent mechanisms in adverse effects caused by concomitant administration of IL-18 and IL-12. J Immunol. 2000 Mar 15;164(6):3330-6. doi: 10.4049/jimmunol.164.6.3330. PMID: 10706727.
https://pubmed.ncbi.nlm.nih.gov/10706727/
