

Explorer les étapes du processus de développement d’un médicament avec un CRO expérimentée
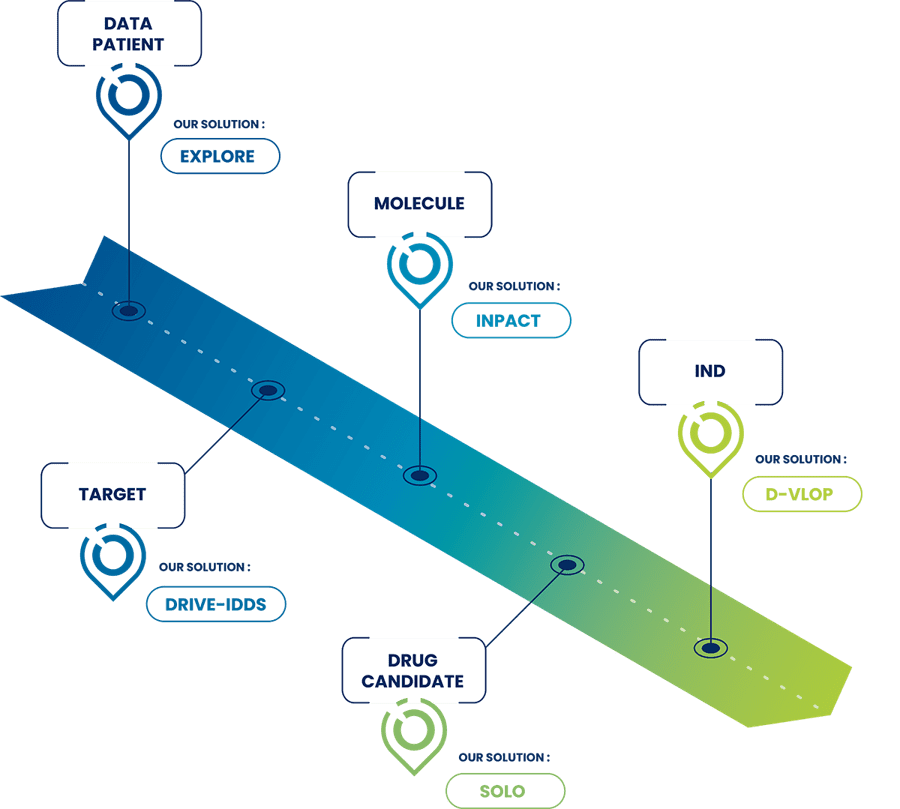
Le processus de développement d’un médicament constitue une approche structurée pour développer et amener un nouveau médicament de la découverte initiale à la disponibilité sur le marché. Oncodesign Services accompagne les entreprises biotechnologiques et pharmaceutiques de la cible à l’IND.
Quelles sont les principales étapes du processus de développement d’un médicament ?
Phase de découverte et de développement
Cette phase implique l’identification et la recherche de nouveaux composés ou molécules médicamenteuses susceptibles de traiter une condition médicale ou une maladie spécifique. Cela commence souvent par des recherches en laboratoire et des tests sur des milliers de composés.
Etudes précliniques
Avant de tester un composé médical chez l’homme, des études précliniques sont menées pour évaluer l’innocuité, l’efficacité et la toxicité potentielle du candidat-médicament. Ces études impliquent généralement de tester le médicament avec des tests in vitro et des modèles in vivo en laboratoire.
Phase clinique
Des essais cliniques sont menés sur des volontaires humains pour évaluer l’innocuité et l’efficacité du candidat-médicament. Cette phase est généralement divisée en trois étapes :
- Phase I : implique de tester le médicament sur un petit groupe de volontaires sains pour évaluer son innocuité, sa posologie et ses effets secondaires.
- Phase II : implique de tester le médicament sur un groupe plus large de patients atteints de la maladie cible afin d’évaluer davantage son innocuité et son efficacité.
- Phase III : implique de tester le médicament sur un groupe encore plus large de patients pour confirmer son efficacité, surveiller les effets secondaires et le comparer aux traitements existants.
Examen et approbation de la FDA
Après la réussite des essais cliniques, le développeur de médicaments soumet une demande de nouveau médicament (NDA) ou une demande de licence de produit biologique (BLA) aux agences de réglementation telles que la FDA (Food and Drug Administration) aux États-Unis ou l’EMA (Agence européenne des médicaments). en Europe. Les agences de réglementation examinent les données pour évaluer la sécurité, l’efficacité et la qualité du médicament. Si l’agence de réglementation approuve le médicament, il peut être commercialisé et mis à la disposition des patients.
Oncodesign Services accompagne les entreprises dans le démarrage du processus de développement de médicaments
Oncodesign Services est une organisation de recherche sous contrat (CRO) avec plus de 25 ans d’expérience dans la découverte précoce de médicaments et les services précliniques, pour contribuer au développement de thérapies innovantes contre des maladies à besoins médicaux élevés.
Nous fournissons des recherches et des services en matière de découverte de médicaments et d’études précliniques, avec des solutions intégrées en oncologie, inflammation et maladies infectieuses.

Drug development phases
Oncodesign Services offre tout le processus de développement de médicaments pour fournir des candidats médicaments, notamment :
- Chimie médicale
- Bioanalyse
- Biologie in vitro
- Etudes d’imagerie
- DMPK
- Pharmacologie in vivo
Découvrez ce que nous pouvons vous proposer selon le stade de développement de votre projet de découverte de médicaments !