

Briser les barrières dans le développement de médicaments oncologiques :
Dévoiler le potentiel des modèles cellulaires 3D pour la découverte de médicaments
Dans le paysage en constante évolution de la découverte de médicaments oncologiques, les chercheurs recherchent continuellement des approches innovantes pour combler le fossé entre les expériences en laboratoire et le succès clinique. Un progrès remarquable dans cette direction vient du domaine des modèles cellulaires in vitro 3D, qui comprennent des micro-tumoroïdes, des organoïdes de tumeurs, des sphéroïdes de lignées cellulaires et des organoïdes de xénogreffe dérivée de patients (PDX). Ces modèles avancés révolutionnent la façon dont nous comprenons, dépistons et développons des traitements contre le cancer, offrant une meilleure approximation de la complexité des tumeurs humaines.
L’un des principaux avantages de ces modèles cellulaires 3D réside dans leur proximité avec la réalité complexe des tumeurs des patients. En reproduisant les interactions cellulaires complexes et les conditions physiologiques trouvées dans le corps humain, ces modèles offrent une plus grande probabilité d’identifier des médicaments qui se traduiront avec succès par des essais cliniques. Cet alignement entre les résultats des laboratoires et les résultats pour les patients constitue un puissant moteur d’accélération du processus de développement de médicaments.
Transformer la science du cancer avec des modèles cellulaires 3D
Les cultures cellulaires 2D traditionnelles constituent depuis longtemps la norme dans la recherche en laboratoire, mais elles ne parviennent souvent pas à reproduire la complexité des environnements in vivo. Entrez les sphéroïdes dérivés de lignées cellulaires, qui sont des agrégats cellulaires 3D dérivés de lignées cellulaires. Contrairement aux cultures 2D, les sphéroïdes imitent plus précisément les interactions cellule-cellule et les gradients de nutriments et d’oxygène présents dans les tumeurs. Ce microenvironnement plus réaliste améliore notre compréhension de la pénétration, de la toxicité et de l’efficacité des médicaments, fournissant ainsi une meilleure base pour le dépistage des médicaments.
Les micro-tumoroïdes représentent une avancée révolutionnaire dans l’imitation de l’environnement complexe des tumeurs en laboratoire. Ces minuscules structures 3D sont composées d’une combinaison de cellules cancéreuses et de cellules stromales de soutien. En recréant le microenvironnement entourant les tumeurs, les micro-tumoroïdes permettent aux chercheurs d’observer comment les cellules cancéreuses interagissent avec les cellules voisines, les composants de la matrice extracellulaire et les vaisseaux sanguins. Cette interaction dynamique offre des informations précieuses sur la croissance tumorale, l’invasion et la réponse aux agents thérapeutiques.
Les organoïdes dérivés de tumeurs font passer la personnalisation à un niveau supérieur. En cultivant des cellules tumorales spécifiques à un patient, ces modèles préservent les caractéristiques génétiques et moléculaires uniques de chaque cancer. Les chercheurs peuvent étudier la réponse de ces organoïdes tumoraux à divers composés médicamenteux, aidant ainsi à adapter les traitements au profil tumoral spécifique d’un patient. Cette approche est extrêmement prometteuse pour la médecine personnalisée, où les traitements peuvent être personnalisés pour cibler les vulnérabilités de la tumeur d’un patient.
Parmi ces modèles, les organoïdes de xénogreffe dérivée de patients (PDX) (PDXO) brillent comme une incarnation du potentiel translationnel. Fusionnant les avantages des modèles PDX et de la technologie organoïde, ces modèles conservent la diversité génétique et la complexité des tumeurs tout en permettant des tests de médicaments à haut débit. L’application révolutionnaire implique l’utilisation de la manipulation génétique dans les PDXO, obtenue soit en améliorant l’expression de cibles spécifiques, soit en mettant en œuvre l’inactivation de gènes via la technologie CRISPR. Cette approche approfondit non seulement notre compréhension des réponses individuelles des patients aux traitements, mais facilite également les études in vivo utilisant des modèles correspondants, favorisant ainsi un pont entre les découvertes en laboratoire et les applications cliniques.
La technologie CRISPR est un outil révolutionnaire d’édition de gènes qui exploite la précision de la biologie moléculaire pour modifier des séquences d’ADN spécifiques dans le génome d’un organisme. Dans la découverte préclinique de médicaments contre le cancer, CRISPR est utilisé pour créer des modifications génétiques précises dans les cellules cancéreuses, permettant aux chercheurs d’étudier le rôle de gènes spécifiques dans le développement et la progression du cancer. En ciblant et en modifiant les gènes associés au cancer, les scientifiques peuvent obtenir des informations précieuses sur les cibles potentielles des médicaments, évaluer l’efficacité des médicaments candidats et développer des thérapies personnalisées adaptées au profil génétique d’un individu. Cette technologie a considérablement accéléré le rythme de la recherche sur le cancer et est extrêmement prometteuse pour le développement de nouveaux traitements ciblés contre le cancer.
Parmi les applications multiformes des modèles cellulaires 3D in vitro, l’utilisation des PDXO dans les cribles phénotypiques se distingue comme une approche transformatrice. Les criblages phénotypiques consistent à observer les effets de candidats médicaments potentiels sur l’ensemble de l’organisme ou, dans ce cas, le modèle 3D de la tumeur. Cette approche globale aide non seulement à identifier les pistes potentielles de médicaments, mais constitue également une étape cruciale dans le raffinement de la chimie pour l’optimisation des pistes et la découverte de nouvelles cibles.
Au-delà de leur potentiel clinique, l’intégration de modèles cellulaires 3D présente également des avantages éthiques et pratiques. Ces modèles réduisent considérablement la nécessité de l’expérimentation animale, s’alignant sur les pratiques de recherche éthiques et accélérant le développement de médicaments en éliminant les couches d’expérimentation les moins pertinentes.
De plus, l’abondance de matériel expérimental facilitée par les modèles cellulaires 3D constitue un avantage significatif. Ces modèles permettent également la manipulation génétique, permettant l’exploration des mécanismes moléculaires sous-jacents aux réponses aux médicaments, ouvrant la voie à de nouvelles découvertes thérapeutiques.
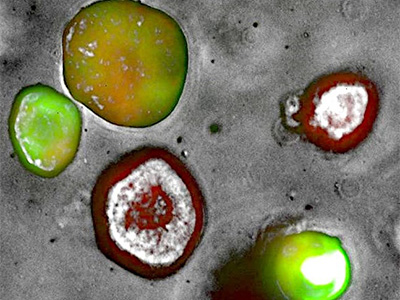
PDAC PDX-Organoid stably transfected using a tri-cistronic engineered vector expressing mCherry-EGFP-NanoLuc
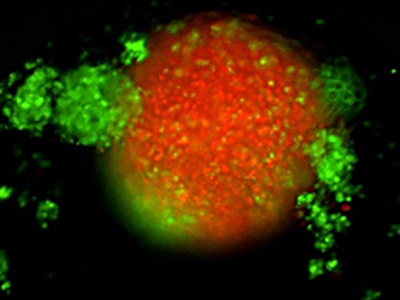
TNBC 3D spheroid expressing Kate2 (red) under attack by activated T cells (green)
Données précliniques robustes pour une preuve de concept in vitro
Chez Oncodesign Services, nous avons préparé avec succès de nombreux modèles PDXO et les avons soumis à diverses manipulations, telles que des traitements médicamenteux, des combinaisons de médicaments et une édition précise du génome à l’aide de techniques CRISPR ou lentivirus. Ces efforts ont considérablement amélioré notre compréhension des liens complexes entre les cibles thérapeutiques et leurs mécanismes d’action, tout en fournissant une preuve de concept in vitro inestimable. Ces processus rationalisés sont particulièrement avantageux pour accélérer le cycle de conception-fabrication-test au sein de notre équipe intégrée, qui comprend des experts en chimie, en DMPK (métabolisme et pharmacocinétique des médicaments) et en biologie in vitro. De plus, les mêmes modèles PDX peuvent être évalués plus en détail pour valider leurs propriétés pharmacologiques in vivo, garantissant ainsi des informations précliniques complètes.
En conclusion, le changement de paradigme provoqué par les modèles cellulaires 3D in vitro remodèle le paysage de la découverte de médicaments en oncologie. Des micro-tumoroïdes et organoïdes tumoraux aux organoïdes dérivés du PDX, ces modèles fournissent une représentation plus précise de la réalité des patients, réduisant le recours aux modèles animaux, offrant davantage de matériel expérimental et permettant des manipulations génétiques. À mesure que nous avançons, il est clair que ces modèles 3D continueront de jouer un rôle central dans l’accélération du développement de thérapies efficaces contre le cancer, se traduisant à terme par de meilleurs résultats pour les patients luttant contre cette redoutable maladie.
A propos de l’auteur
Cet article de blog a été rédigé par le Dr Nicolas Ancellin, directeur de projet stratégique chez Oncodesign Services. Il est un biologiste cellulaire et moléculaire expérimenté, spécialisé dans la découverte de médicaments. Dans son rôle actuel, Nicolas est impliqué dans Explore, notre offre conçue pour soutenir l’identification et la validation de cibles thérapeutiques.