Pourquoi considérer le microenvironnement tumoral pour le traitement du cancer ?


Juin, 2023 l Olivier Duchamp & Sylvie Maubant
Le développement de la résistance aux médicaments dans le cancer est lié à plusieurs mécanismes de diminution de l’efficacité des médicaments, qui sont fortement influencés par l’hétérogénéité intratumorale et les modifications du microenvironnement tumoral (TME). L’hétérogénéité des tumeurs est l’un des principaux facteurs d’échec thérapeutique et d’issue fatale, et représente un défi majeur pour les objectifs de la médecine de précision. Bien que l’hétérogénéité du cancer soit classiquement attribuée à la diversité génétique par analogie avec l’évolution darwinienne, les données actuelles révèlent que, outre les facteurs génétiques, l’hétérogénéité tumorale peut provenir d’altérations épigénétiques provoquées par des événements stochastiques induits par des signaux physiques et chimiques provenant du TME.
Ci-après, nous examinons trois acteurs essentiels du TME qui intéressent de plus en plus la communauté scientifique.
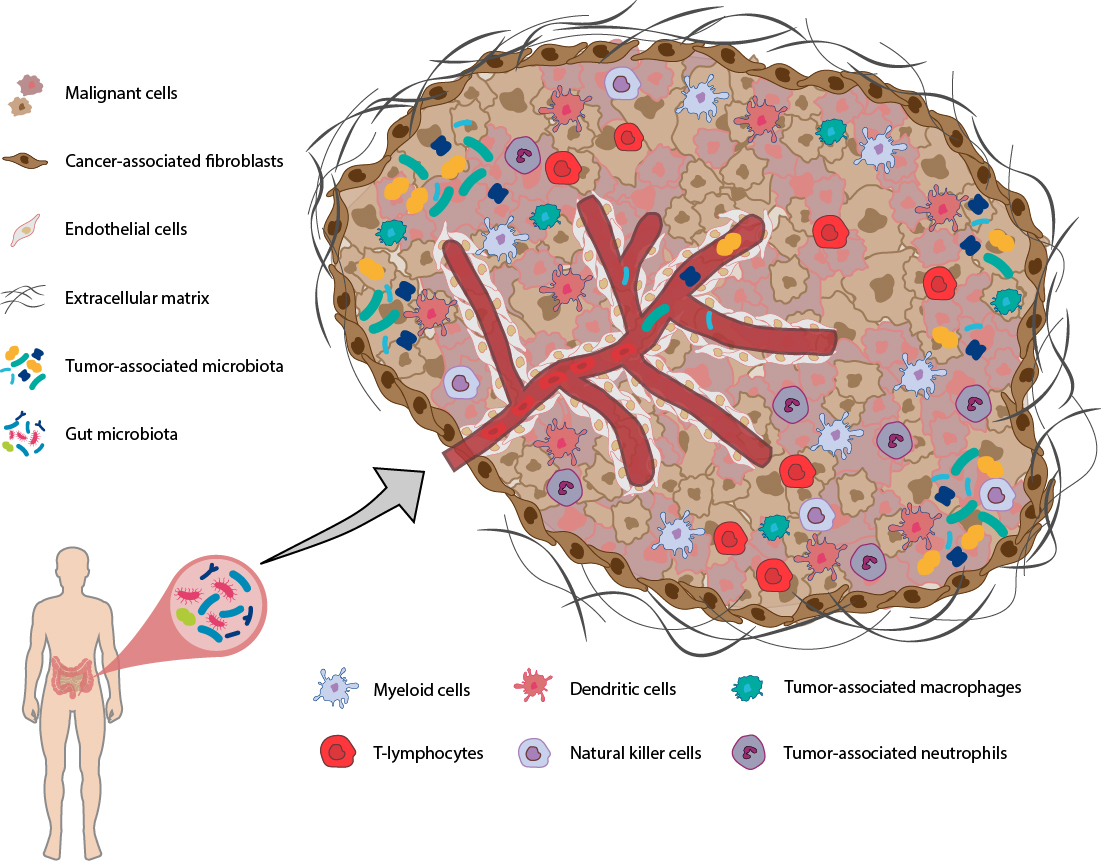
Le TME est un écosystème hautement structuré qui entoure les cellules cancéreuses. Il comprend diverses cellules immunitaires (par exemple les lymphocytes T et B, les macrophages, les cellules dendritiques, les cellules tueuses naturelles, les cellules myéloïdes suppressives, les neutrophiles et les éosinophiles), les cellules stromales (principalement les fibroblastes), les vaisseaux sanguins et lymphatiques, les cellules spécifiques des tissus (par ex. neurones et adipocytes), les micro-organismes (dont les bactéries sont les membres les plus nombreux) ainsi que la matrice extracellulaire et d’autres molécules sécrétées (telles que les facteurs de croissance, les cytokines, les chimiokines, les métabolites). Ces composants peuvent varier selon le type de tissu et co-évoluer avec le développement de la tumeur. Compte tenu du rôle central du TME dans la progression tumorale et dans la régulation de l’efficacité du traitement du cancer, les stratégies exploitant le TME se sont considérablement développées ces dernières années (1, 2).
1. Macrophages associés aux tumeurs (TAM) |
 |
Les TAM constituent un composant majeur de l’infiltrat leucocytaire dans le TME. Au cours de la progression tumorale, les TAM sont polarisés d’un phénotype de type M1 à un phénotype de type M2 en réponse aux signaux dérivés du TME. Les TAM M2 inhibent activement la prolifération et l’activité des cellules T cytotoxiques et favorisent l’expansion des cellules T régulatrices, atténuant ainsi les réponses immunitaires de l’hôte contre la tumeur. De plus, ces TAM M2 jouent un rôle clé dans l’orchestration de la prolifération et de la survie tumorales, de l’angiogenèse et des métastases. À l’inverse, les TAM M1 peuvent médier la phagocytose des cellules cancéreuses et la destruction cytotoxique des tumeurs.
Malgré l’éventail de fonctions différentes que les TAM peuvent exécuter, l’abondance accrue des TAM est le plus souvent associée à de mauvais résultats pour les patients et à une résistance au traitement par inhibiteur de point de contrôle, soulignant leur potentiel en tant que biomarqueurs pronostiques et cibles thérapeutiques. Plusieurs essais cliniques combinant des inhibiteurs de points de contrôle et des anticorps anti-CSF1R (inhibition attendue de la prolifération et de la survie du TAM) ou d’autres stratégies thérapeutiques basées sur le TAM sont en cours [3, 4]. Cependant, malgré une déplétion significative des TAM par le traitement anti-CSF1R, des effets antitumoraux différentiels peuvent être observés et liés au phénotype TME.
Par exemple, un criblage sur plusieurs modèles de tumeurs syngéniques de souris a révélé que seul le modèle de cancer du rein murin Renca était réactif, un résultat expliqué par une augmentation de l’infiltration de neutrophiles dans la tumeur induite par les chimiokines sécrétées par les fibroblastes suite à l’inhibition du CSF1R [5, 6].
2. Fibroblastes associés au cancer (CAFs) |
 |
L’un des composants les plus dominants du stroma tumoral est le CAF, qui fournit non seulement un soutien physique aux cellules tumorales, mais joue également un rôle clé dans la promotion de la tumorigenèse ou dans la limitation de la croissance du cancer. Les CAF peuvent moduler le recrutement et l’activité des composants immunitaires innés et adaptatifs au sein du TME ainsi que le dépôt et le remodelage de la matrice extracellulaire (ECM).
Des progrès significatifs ont été réalisés dans les thérapies ciblées sur les FAC ces dernières années. Ces approches visent principalement à (a) épuiser directement ou indirectement les CAF, (b) réduire ou éliminer les fonctions tumorales et immunosuppressives des CAF, ou (c) normaliser ou reprogrammer les CAF dans un état plus calme. Néanmoins, plusieurs défis demeurent, comme l’identification de marqueurs CAF plus spécifiques, la définition des fonctions et la localisation des différentes sous-populations CAF au cours de la progression tumorale, et enfin le développement d’agents suffisamment spécifiques pour épargner les cellules stromales normales dans les tissus sains [7, 8].
Pour atteindre cet objectif, des modèles précliniques encore plus prédictifs doivent être développés. Chez Oncodesign Services, nous savons que le stroma (c’est-à-dire principalement les CAF) est fortement représenté dans les tumeurs de rat par rapport aux tumeurs de souris et il est donc probable que les modèles de rats imitent mieux la situation clinique. Cependant, en cas de greffe d’une tumeur humaine sur ces animaux, les fibroblastes humains sont rejetés et remplacés par ceux de rongeurs. Cela signifie que d’autres alternatives technologiques telles que les systèmes organoïdes et la bio-impression 3D qui récapitulent les interactions complexes in vitro entre tumeur et stroma doivent également être envisagées pour tester des thérapies ciblant les composants du TME [9].
3. Microbiote |
 |
Au cours de la dernière décennie, le nombre d’études démontrant le rôle important du microbiote intestinal dans le développement du cancer et la réponse au traitement a considérablement augmenté. Il a été démontré que le microbiote intestinal régule non seulement la réponse thérapeutique, mais également la toxicité de plusieurs thérapies, notamment la chimiothérapie, les greffes de cellules souches et l’immunothérapie. Par exemple, plusieurs études ont révélé que certaines signatures du microbiote intestinal sont associées à une meilleure réponse aux inhibiteurs de points de contrôle immunitaires, à une infiltration plus élevée de cellules immunitaires dans les tumeurs et à une immunité systémique renforcée (10, 11).
Ces dernières années, l’étude du microbiote intratumoral a attiré davantage d’attention et a réalisé certains progrès, même si des recherches supplémentaires sont indéniablement nécessaires pour mieux comprendre son rôle dans la biologie du cancer. Le microbiote intratumoral a diverses sources (micro-organismes provenant de sites muqueux à travers des barrières muqueuses, de tissus normaux adjacents ou d’organes, y compris les intestins et transportés par le sang jusqu’aux sites tumoraux), la composition des organes et la distribution tissulaire, et peut être inextricablement lié au microbiote intestinal.
De plus en plus de preuves suggèrent que le microbiote intratumoral joue un rôle clé dans la formation des réponses immunitaires locales du TME, ce qui affecte en outre l’initiation et la progression de la tumeur, l’efficacité et les résultats de l’immunothérapie. Les microbes intestinaux agissent indirectement sur le TME via leurs métabolites ou le système immunitaire, ce qui peut également avoir un impact sur la composition et la fonction du microbiote intratumoral, ajoutant ainsi ici un autre niveau de diaphonie au sein du TME (12, 13).
Le cancer résulte d’une adaptation évolutive des cellules malignes à leur microenvironnement. Ainsi, une compréhension approfondie des mécanismes qui médient les réponses biologiques adaptatives est cruciale pour faire progresser notre guerre contre le cancer, dans laquelle des modèles néo-darwiniens et néo-lamarckiens d’évolution adaptative doivent être pris en compte pour anticiper et contourner la résistance thérapeutique. Et au lieu de tuer les cellules tumorales par des médicaments débilitants adaptés à des cibles moléculaires spécifiques, cette approche devrait mieux soutenir le développement de thérapies ou de nouvelles combinaisons de médicaments ciblant plusieurs composants du TME visant à prévenir ou à modifier les conditions microenvironnementales qui permettent aux cellules cancéreuses de survivre.
Ce blog a été rédigé par :
Vous souhaitez échanger avec nos experts ?
[1] Bejarano et al (2021). Therapeutic targeting of the tumor microenvironment. Cancer Discov, 11: 933-59. DOI: 1158/2159-8290.cd-20-1808
[2] Tiwari et al (2022). Tumor microenvironment: barrier or opportunity towards effective cancer therapy. J Biomed Sci, 29 (1): 83. DOI: 1186/s12929-022-00866-3
31] Mantovani et al (2022). Macrophages as tools and targets in cancer therapy. Nat Rev Drug Discov, 21 (11), 799-820. DOI: 1038/s41573-022-00520-5
[4] Mishra et al (2023). Macrophages as a potential immunotherapeutic target in solid cancers. Vaccines, 11 (1): 55. DOI: 3390/vaccines11010055
[5] Kumar et al (2017). Cancer-associated fibroblasts neutralize the anti-tumor effect of CSF1 receptor blockade by inducing PMN-MDSC infiltration of tumors. Cancer Cell, 32 (5): 654-68. DOI: 1016/j.ccell.2017.10.005
[6] O’Brien et al (2021). Activity of tumor‑associated macrophage depletion by CSF1R blockade is highly dependent on the tumor model and timing of treatment. Cancer Immunol Immunother, 70: 2401-10. DOI: 1007/s00262-021-02861-3
[7] Sahai et al (2020). A framework for advancing our understanding of cancer-associated fibroblasts. Nat Rev Cancer, 20 (3): 174-86. DOI: 1038/s41568-019-0238-1
[8] Glabman et a (2022). Cancer-associated fibroblasts: tumorigenicity and targeting for cancer therapy. Cancers, 14 (16): 3906. DOI: 3390/cancers14163906
[9] Rodrigues et al (2021). 3D in vitro model (r)evolution: unveiling tumor-stroma interaction. Trends Cancer, 7 (3): 249-64. DOI: 1016/j.trecan.2020.10.009
[9] Routy et al (2018). The gut microbiota influences anticancer immunosurveillance and general health. Nat Rec Clin Oncol, 15 (6): 382-96. DOI: 1038/s41571-018-0006-2
[10] Fernandes et al (2022). Targeting the gut microbiota for cancer therapy. Nat Rev Cancer, 22: 703-22. DOI: 1038/s41568-022-00513-x
[11] Sepich-Poore et al (2021). The microbiome and human cancer. 371 (6536): eabc4552. DOI: 10.1126/science.abc4552
[12] Yang et al (2023). Intratumoral microbiota: roles in cancer initiation, development and therapeutic efficacy. Signal Transduct Target Ther, 8 (1): 35. DOI: 1038/s41392-022-01304-4
oncology, tumor microenvironment, tumor-associated macrophages, cancer-associated fibroblasts, tumor microbiota, gut microbiota